以下内容由AI大模型生成,仅供参考,不能保证完全真实,请仔细甄别,欢迎吐槽纠正!

一、作用机制与核心差异
1、疫苗免疫的核心机制
疫苗通过模拟自然感染激发免疫记忆,形成特异性抗体和细胞免疫屏障。根据技术路线不同,其作用存在显著差异:
灭活疫苗(如H1N1/H3N2双价灭活疫苗):通过肌肉注射诱导血清抗体(如HI抗体≥1:160即为保护水平),但对呼吸道局部免疫刺激较弱。
减毒活疫苗(如温度敏感型活疫苗):经鼻喷或口服给药,可激活呼吸道粘膜IgA抗体和CD4+/CD8+ T细胞,形成"黏膜-全身"双重保护。
新型疫苗技术(如DNA疫苗、壳聚糖纳米疫苗):通过靶向递送多价抗原(如HA、NA、NP等保守蛋白),诱导交叉反应性IgG和IFN-γ分泌型T细胞,突破病毒变异限制。
2、药物治疗的作用靶点
以奥司他韦(Tamiflu)为代表的神经氨酸酶抑制剂,通过阻断病毒颗粒释放实现快速抑制。但需在感染后48小时内给药,且无法阻止病毒侵入细胞。
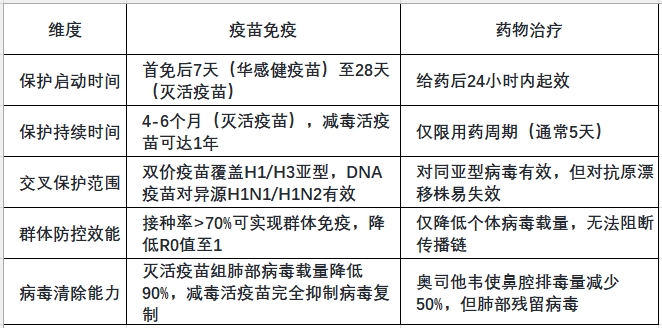
二、效果与时效性对比
三、技术优势与局限性
(一)疫苗免疫的优势与挑战
1、优势:
长效经济:单头猪免疫成本约3-5元,覆盖出栏周期
技术迭代:mRNA疫苗研发周期缩短至8周,可快速应对变异
协同防控:华感健等二价疫苗显著降低继发感染率
2、局限性:
匹配风险:抗原不匹配疫苗(如H1N2灭活疫苗)可能加重H1N1感染症状
生产瓶颈:传统鸡蛋培养工艺产能利用率仅30%,新型佐剂(如IMS1315)提升有限
操作门槛:需冷链运输和精准免疫程序(如母猪配种前双次接种)
(二)药物治疗的优势与缺陷
1、优势:
紧急干预:暴露后预防有效率>80%
适用场景:6周龄以下仔猪无法接种时的替代方案
协同治疗:与解热药(卡巴匹林钙)联用可提升采食量
2、缺陷:
耐药风险:2009年后H1N1对奥司他韦耐药率升至15%
成本压力:全程治疗成本达10-15元/头,规模化场难以承受
副作用:幼猪使用后呕吐率高达12%
四、实际应用场景选择
1、优先疫苗免疫的场合
母猪群体:通过母源抗体传递(HI效价≥1:20),保护哺乳仔猪
高密度养殖区:采用DNA疫苗无针注射技术,实现1000头/小时接种效率
病毒变异高发区:使用壳聚糖纳米疫苗增强粘膜免疫,阻断"禽-猪-人"传播链
2、依赖药物治疗的情形
疫情暴发初期:在疫苗空白期采用奥司他韦+替米考星组合压制病毒扩散
免疫抑制个体:蓝耳病阳性场中继发流感感染的紧急处置
跨境运输管控:隔离期间短期预防用药降低传播风险
五、协同应用与风险规避
1、疫苗-药物联用策略
免疫增强方案:α-GalCer佐剂疫苗使NKT细胞浓度提升3倍,病毒清除率提高至100%
风险对冲组合:灭活疫苗首免后补充DNA疫苗,规避抗原漂移风险
治疗性免疫:在药物治疗控制病毒载量后,补种减毒活疫苗建立持久免疫
2、关键风险警示
免疫增强疾病(Vaccine-enhanced disease):使用不匹配灭活疫苗导致肺炎发生率增加2.3倍
抗体依赖增强(ADE):低效价母源抗体可能加重仔猪感染
药物滥用诱导超级病毒:奥司他韦不规范使用加速PB2-E627K突变株出现
六、未来技术突破方向
1、第三代疫苗技术
通用疫苗设计:靶向M2e和NP保守表位的mRNA疫苗,覆盖9种血清型
智能递送系统:温度响应型纳米颗粒实现单次接种持续释放抗原
跨物种保护:表达人流感HA嵌合抗原的猪用疫苗,阻断人畜共传
2、精准用药体系
耐药性监测网络:基于全基因组测序的奥司他韦敏感性实时预警
AI辅助决策:结合病毒载量、抗体滴度和环境参数优化给药方案
缓释制剂开发:植入式药物芯片实现28天持续释放
结论
在养猪业中,疫苗免疫是构建生物安全体系的基石,而药物治疗是应对突发疫情的必要补充。灭活疫苗与减毒活疫苗的技术迭代显著提升了保护效能,但需警惕抗原匹配风险;奥司他韦等药物虽能快速控场,但受限于耐药性和经济成本。未来通过"黏膜疫苗+缓释药物"的协同方案,结合AI驱动的精准防控,有望实现猪流感从被动应对到主动消除的跨越。
来源:综合腾讯元宝、秘塔、deepseek等。